Классификация ушибов головного мозга корниенко
Компьютерная томография (КТ) в настоящее время является ведущим в диагностике черепно-мозговой травмы. Возможность прижизненной визуализации мягких тканей, костей, мозговой паренхимы, ликворных пространств, инородных тел и других составляющих черепно-мозговой травмы при КТ открыла новые пути развития нейротравматологии. Широкое распространение получила КТ и в детской нейротравматологии
Ушибы мягких тканейхарактеризуются увеличением объема, сочетанием с участками повышенной плотности в результате пропитывания их кровью. Подапоневротические гематомыотличаются зонами повышенной плотности в ранние сроки после травмы, которые располагаются над костными структурами.
Переломы костей черепавизуализируются при КТ в костном режиме. Линейные переломы представлены в виде полосок просветления, а вдавленные переломы в виде смещения фрагментов кости в полость черепа (Рис.7.22).
Ушибы головного мозгав зависимости от тяжести (выраженности) деструктивных изменений мозговой ткани обычно разделяют на 3 типа. Частота их выявления увеличивается с увеличением срока после травмы. По данным Егуняна М.А., в первые сутки после травмы КТ признаки ушиба мозга обнаруживаются у 23% обследованных детей, кроме того у 18% обнаруживаются признаки отека мозга с сужением субарахноидальных пространств и желудочков мозга. На 2 – 3 сутки ушибы мозга выявляются уже у 33,3% пострадавших, при наличии признаков отека мозга еще у 11,1%. На 4 – 7 сутки эти цифры поднимаются до 66,6% и 33,4%.
Ушибы мозга легкой степени тяжести (ушибы I типа)представлены небольшими зонами пониженной плотности мозгового вещества (18 – 25 ед.Н) или участками изоденсивными мозгу с наличием небольшого объемного эффекта позволяющие говорить об ушибе мозга. Эти ушибы достаточно быстро (2-6 дней) подвергаются обратному развитию и обычно занимают кортикальную зону конвекситальных отделов полушарий мозга, часто сочетаясь с переломами костей и подапоневротическими гематомами.
Ушибы мозга средней степени тяжести (ушибы IIтипа)характеризуются наличием контузионных очагов повышенной плотности (до 60 ед.Н) или зонами пониженной плотности с некомпактными вкраплениями участков повышенной плотности (Рис.7.2, 7.24). Степень сопутствующего отека мозга и объемного эффекта большая. Эти очаги ушиба также достаточно быстро (в течение 10 – 14 дней) подвергаются обратному развитию, что говорит об отсутствии значительной деструкции мозгового вещества, но атрофические изменения в мозге обнаруживаются почти постоянно.
Ушибы мозга тяжелой степени тяжести (ушибы III типа)представлены зонами неравномерно повышенной плотности (65 – 75 ед. Н), которые чередуются с участками пониженной плотности (Рис. 7.25).
Данный вид ушиба мозга соответствует патологоанатомическому определению «очаг размозжения мозга». Они сопровождаются выраженным перифокальным отеком, нередко имеющего тенденцию к генерализации на 3 – 4 сутки. Исчезновение геморрагического компонента очагов ушиба 3 вида происходит на 2 – 3 недели, хотя явления отека сохраняются на более длительный срок.
Корниенко В.Н. с соавт. предложили разделять 4 вида очагов ушиба мозга, при этом выделив ушибы IV вида – внутримозговые гематомы или очами ушибов с превалированием геморрагического компонента над мозговым детритом (Рис. 7.26).
Очень интересны сопоставления типов ушибов мозга и летальности, проведенные LankschW. С соавт. Установлено, что летальность при ушибах I типа не превышает 7% наблюдений, при ушибах II типа она составляет 41% и при ушибах III типа достигают 70% наблюдений.
Диффузные аксональные повреждения мозгана КТ характеризуются общим увеличением объема мозга, как результат диффузного отека или набухания мозга с мелкоточечными очагами геморрагии в мозолистом теле, стволовых или перивентрикулярных структурах.
Субарахноидальные кровоизлияниянаиболее частый вид травматических внутричерепных кровоизлияний, особенно при тяжелой черепно-мозговой травме. КТ признаком субарахноидального кровоизлияния является повышение плотности конвекситальных субарахноидальных пространств, боковых щелей мозга, базальных цистерн (Рис.7.27). Учитывая быстроту резорбции крови из ликворных пространств, КТ диагностика субарахноидальных кровоизлияний наивысшая в первые часы после травмы. В течение первых двух суток частота обнаружения КТ признаков геморрагии снижается на половину.
Эпидуральные гематомыпредставлены обычно зонами повышенной плотности двояковыпуклой формы, прилежащей к костям свода черепа (Рис. 7.28). Зоны распространения эпидуральных гематом обычно ограничены черепными швами.
Степень повышения плотности изображения гематомы соответствует количеству свернувшейся крови, но при наличии несвернувшейся крови и при резорбции гематомы более 14 дней возможно ее изоденсивное с мозгом изображение. В этих случаях только косвенные признаки (смещение твердой мозговой оболочки, смещение мозга) или внутривенное введение контрастного вещества позволяют правильно установить диагноз.
Субдуральные гематомыхарактеризуются серповидной зоной повышенной плотности, захватывающей значительные участки над полушариями мозга (Рис.7.29), сочетаясь с его сдавлением и смещением срединных структур. В результате резорбции крови субдуральные гематомы в течении нескольких недель становятся изоденсивными, что затрудняет их диагностику особенно при двухсторонней локализации. Эта локализация очень часто наблюдается у детей грудного возраста. Именно у них нередко возникает необходимость в дифференциальной диагностике между хроническими субдуральными гематомами и хроническими гидромами в результате атрофических изменений в мозге (Рис.7.30, 7.31). Односторонние хронические субдуральные гематомы в зависимости от сроков существования и степени резорбции крови представлены гипер- , гипо- или изоденсивными экстрацеребральными зонами с выраженным смещением мозга (Рис. 7.32).
Особую группу составляют больные с хроническими оссифицирующимися субдуральными гематомами при огромных размерах которых степень смещения мозговых структур и желудочков мозга может быть самой различной от незначительной (Рис.7.33) до резко выраженной (Рис. 7.34).
Внутримозговые гематомычаще встречаются у детей школьного возраста и на КТ представляют собой очаги гомогенно повышенной плотности округлой, овальной или неправильной формы (65 – 75 ед. Н). Очень быстро вокруг гематомы формируется зона отека, достигающая максимума на 2 – 3 сутки и имеющего тенденцию к генерализации (Рис. 7.35). Резорбция крови и снижение плотности очага кровоизлияния обычно происходит к концу месяца.
Внутрижелудочковые гематомыу детей как изолированная форма внутричерепной посттравматической геморрагии встречается крайне редко. Они наблюдаются при очень тяжелой травме как один из компонентов множественных гематом. Внутрижелудочковые кровоизлияния только в том случае может считаться гематомой, если кровь по объему превысила размеры желудочка и произошла тампонада его кровью. На КТ внутрижелудочковые гематомы представлены высокоинтенсивным сигналом, формирующим слепок расширенного желудочка мозга. Чаще обнаруживаются внутримозговые гематомы с прорывом крови в желудочки мозга разной степени выраженности (Рис. 7.36).
Как уже указывалось, практически только у детей встречаются поднадкостнично-эпидуральные гематомы. Их компьютерная диагностика не представляет больших сложностей, а обнаруживаемые изменения весьма характерны для экстра-интракраниальных объемных поражений, разделенных костной структурой. Гематомы могут располагаться одна над другой, принимая вид шара, мяча, или в виде гантелей со смешением основных масс гематом в сторону (Рис.7.37). При специальных исследованиях удается обнаружить и зону линейного перелома кости.
Значительно расширились возможности КТ с внедрением в практику спиральных рентгеновских компьютеров. Если раньше для получения объемного изображения (трехмерная КТ реконструкция) требовалось много времени и больной получал большую лучевую нагрузку, современные аппараты позволяют провести исследование за несколько минут. Особенно важна трехмерная КТ реконструкция при сложных переломах и дефектах черепа, во многом определяя хирургическую тактику (Рис.7.38).
Рис.7.22. КТ (костный режим) ребенка П., 7 лет. Вдавленный многооскольчатый перелом правой лобной кости.
Рис. 7.23. КТ ребенка З., 3 года.
Ушиб лобной области средней степени тяжести без выраженной дислокации и отека мозга.
Рис.7.24. КТ ребенка Н., 12 лет.
Ушиб лобных долей средней степени тяжести (через неделю после травмы). Выраженный отек лобных долей, начинающаяся атрофия левой лобной доли.
Рис.7.25. КТ ребенка А., 7 лет.
Ушиб левой лобной доли тяжелой степени тяжести. Умеренно выражен дислокационный синдром и отек мозга.
Рис. 7.26. КТ ребенка Р., 5 лет.
Ушиб тяжелой степени тяжести лобных долей, больше справа, с преобладанием геморрагического компонента.
Рис.7.27. КТ ребенка Б., 2 года.
Ушиб мозга средней степени тяжести, субарахноидальная геморрагия с распространением крови в межполушарную щель и субарахноидальные пространства правой лобно-теменной области.
Рис.7.28 КТ ребенка Ф., 6 лет.
Эпидуральная гематома левой височной области без значительного дислокационного синдрома.
Рис.7.29. КТ ребенка Т., 3 года.
Острая субдуральная гематома над правым полушарием, выраженное сдавление мозга.
Рис.7.30. КТ ребенка С., 4 года. Двусторонние хронические субдуральные гематомы.
Рис.7.31. КТ ребенка С., 1 год.
Массивные хронические субдуральные гидромы, гипоксическая атрофия мозга.
Рис.7.32. КТ ребенка Б., 9 месяцев.
Хроническая субдуральная гематома левой лобно-теменно-височной области, выраженный дислокационный синдром.
Рис.7.33. КТ ребенка Е., 8 лет.
Оссифицированная хроническая субдуральная гематома правой лобно-теменной области, состояние через 3 года после ликворошунтирующей операции и год после легкой черепно-мозговой травмы. Дислокационный синдром слабо выражен.
Рис.7.34. КТ ребенка М.., 5 лет.
Оссифицирующаяся хроническая субдуральная гематома левой лобно-теменно-височной области, состояние через год после ликворошунтирующей операции. Дислокационный синдром резко выражен.
Рис. 7.35. КТ ребенка Р., 4 года.
Внутримозговая гематома правой височно-подкорковой области со слабо выраженным
дислокационным синдромом.
Рис. 7.36. КТ ребенка Т., 9 лет.
Внутримозговая гематома правой височной области с прорывом крови в тело и задний рог правого бокового желудочка. Умеренно выражен перифокальный отек.
Рис. 7.37. КТ ребенка О., 2 года.
Поднадкостнично-эпидуральная гематома слева. Эпидуральная гематома затылочно-теменная область, поднадкостничная гематома – теменно-височная область. Умеренно выражен дислокационный синдром. При костной реконструкции видна область линейного перелома затылочной кости слева
с переходом на теменную кость.
Рис.7.38. КТ (А) и трехмерная реконструкция (Б) ребенка З., 2 года.
Растущий перелом затылочной и височной костей справа с формированием арахноидальной
экстра-интракраниальной кисты.
Б
Источник
Определение
Ушибы головного мозга – участки анатомической деструкции мозга, возникшие в момент травмы.
МРТ-СЕМИОТИКА
В первые часы МР-картина может быть нормальной! Через 48-72 часа после травмы информативность МРТ увеличивается по сравнению с КТ.
КЛАССИФИКАЦИЯ контузионных очагов ГМ (Корниенко с соавт., 1987 г):
1 тип – МРТ: очаги гиперинтенсивного МРС по Т2 и FLAIR, слабо гипоинтенсивного МРС по Т1, однородные, с нечеткими контурами; КТ: плотность ткани равномерно снижена до +18 – +25 НU, нет геморрагического компонента и деструкции ткани мозга. Часто подвергаются обратному развитию.
2 тип – МРТ: неоднородная интенсивность МРС (гиперинтенсивный МРС по Т2-ВИ; мелкоточечные негомогенные включения гиперинтенсивного МРС по Т1-ВИ – мелкоточечные глиальные геморрагии); КТ: смешанная плотность, наличие геморрагического компонента (высокоплотные мелкоточечные включения в зоне пониженной плотности или умеренно гомогенное повышение плотности в очаге ушиба до +50 HU. В большинстве случаев подвергаются обратному развитию.
3 тип – зона негомогенного МРС (или смешанной плотности по КТ), гиперинтенсивного по Т2 и умеренно гипоинтенсивного по Т1; сочетание внутримозговой гематомы с зоной ишемии и отека (~50х50%). Как правило, участки повышенной плотности +65 – +75 HU – свежие сгустки крови чередуются с участками с плотностью +18 – +25 HU- отечная или размозженная ткань.
4 тип – МРТ: внутримозговая гематома (интенсивность МРС соответствует стадии распада гемоглобина); КТ: единичные или (реже) множественные гомогенные массивные очаги округлой или овальной формы плотностью +65 – + 75 НU (плотность сгустков крови).
По отношению к внутренней капсуле внутримозговые гематомы делятся на медиальные и латеральные.
При динамическом наблюдении иногда прослеживается трансформация первых трех типов ушибов мозга в гомогенные очаги повышенной плотности.
Между геморрагическими ушибами 3 и 4 типов не всегда имеется четкое различие.
МР-картина внутримозговой гематомы в зависимости
от стадии распада гемоглобина
ДРУГИЕ МЕТОДЫ ВИЗУАЛИЗАЦИИ
КТ – метод выбора в острейшую и острую стадии (первые 24 ч – 3 дня); обнаруживает костную патологию (переломы) и некоторые типы ранних кровотечений (САК и острые паренхиматозные кровоизлияния)
Рентгенография черепа: рентгенологическая норма или различные переломы черепа.
Ангиография головного мозга: различные виды дислокации магистральных сосудов, участок сосудистого спазма в острой/подострой стадии.
ОФЭКТ (SPECT): более чувствительна, может отображать изменения, даже если результаты КТ и МРТ являются нормальными. Результаты SPECT особенно чувствительны у пациентов с легкой степенью тяжести травмы, иногда используются для определения долгосрочного прогноза.
ПЭТ: не ясно, является ли исследование более полезным, чем сканирование МРТ или КТ. В настоящее время нет общепринятых клинических рекомендаций. Изображения PET более анатомически детализированы, чем изображения SPECT.
МР-спектроскопия (1H-MRS): можно обнаружить аномальные изменения метаболитов в мозге после травмы раньше, чем при обычной МРТ; использовать для определения долгосрочного прогноза.
Клинические проявления
Строгого соответствия между анатомическим повреждением мозга и клинической картиной может и не быть. Зависит это от локализации очага ушиба, его обширности и, наиболее часто, от вторичных процессов, развивающихся вокруг этого очага (степени нарушения мозгового кровообращения как локального, так и полушарного, отека мозга регионарного или полушарного, вызывающего дислокацию мозга в виде различной степени выраженности поперечного или аксиального смещения, и пр.).
Головная боль, рвота, тошнота, головокружение, сниженная реакция, вплоть до потери сознания, гемипарез, глазодвигательные нарушения.
Лучевая диагностика
Пример контузионного очага I типа (Автор: Morales D.L. Brain contusion Imaging. Medscape/ Drag&Diseases/ Radiology. Nov 01, 2015 https://emedicine.medscape.com/article/337782-overview)
А. КТ с контрастным усилением, выполненная непосредственно после травмы: инородное тело волосистой части головы (зона прямого удара, коричневая стрелка). Наличие крови в правом боковом желудочке (красная стрелка).
В. Т1-ВИ аксиальный скан, 1 сутки после травмы: зона минимального интракортикального повышения МРС в зоне, подлежащей месту травмы (кортикальная контузия, синяя стрелка).
С. Т1-ВИ с контрастным усилением: минимальное интракортикальное усиление в левой задней теменно-затылочной зоне (синяя стрелка).
D. T2-FLAIR: выявляется более обширная зона контузии на интра-и субкортикальном уровне (синяя стрелка). Также отмечается гиперинтенсивный сигнал в правом боковом желудочке (кровь в ЦСЖ, красная стрелка) с перифокальным отеком зрительной лучистости (желтые стрелки).
Пример контузионных очагов II типа в лобных долях, Т2-FLAIR (Bamford R., MRCS, Singh-Ranger G, MS. FRCS Unilateral internuclear ophtalmoplegia after minor injury, Western Journal of Emergency Medicine, 2011)
Пример контузионного очага III типа (Автор: Morales D.L. Brain contusion Imaging. Medscape/ Drag&Diseases/ Radiology. Nov 01, 2015 https://emedicine.medscape.com/article/337782-overview)
А. КТ. В. Т1 натив. С. T1-SE. D. N2-SE. E. FLAIR. F. DWI.
Дифференциальный диагноз
Дифференциальный диагноз: геморрагический инсульт, венозный инсульт, конгофильное кровоизлияние, ДАП, кавернома.
Пример описания
В …… доле, интра-, субкортикально определяется контузионный геморрагический очаг (3 типа) размерами … см. В субкортикальных отделах белого вещества …… извилины справа определяется округлой формы контузионный (негеморрагический) очаг I типа размерами … см.
В …… доле (проекции ……… извилин), преимущественно интракортикально, определяются мелкие контузионные негеморрагические очаги (1 типа) размерами ….см и … см.
Заключение: МР картина контузионных смешанных очагов (I и III типа) …. долей.
Список использованной литературы и источников
1. Зартор К., Хэннэль С., Кресс Б. Лучевая диагностика. Головной мозг, Москва 2013 г.
2. Корниенко В.Н., Пронин И.Н. Дианостическая нейрорадиология, Москва, 2006 г
3. Лебедев В.В., Крылов В.В., Мартыненко А.В., Халчевский В.М. НИИ СП им. Н.В. Склифосовского, ГКБ № 33, Москва, Россия Клинико-компьютернотомографическая классификация ушибов головного мозга
4. Труфанов Г.Е. , Рамешвили Т.Е. Лучевая диагностика травм головы и позвоночника, С-Петербург, 2007 г
5. Bamford R., MRCS, Singh-Ranger G, MS. FRCS Unilateral internuclear ophtalmoplegia after minor injury, Western Journal of Emergency Medicine, 2011
6. Bozena Kubas, Wojciech Lebkowski Proton MR spectroscopy in mild traumatic brain injury NCBI Journal list > Pol J Radiol > v.75(4); Oct-Dec 2010
7. Bruce Lee, Andrew Newberg Neuroimaging in Traumatic Brain Imaging NeuroRX The Journal of the American Society for Experimental Neurotherapeutics 2005 Apr, 2 (2): 372-383
8. Denise L. Morales, MD, James G Smirniotopoulos, MD. Brain contusion imaging Medscape 1.11.2015
9. Yong Xiao, Yigang Fu Proton Magnetic Resonance Spectroscopy (1H-MRS) Study of Early Traumatic Brain Injury in Rabbits NCBI Journal list > Med Sci Monit. 2017; 23: 2365-2372
Источник
˸ – : / .., .., .. . .: , 2016. 23 .
˨ –
XXXXIII . -, 15 2016 .
2016
:
, , , . . ..
, , . . ..
,, . . ..
, , – . . ..
, . . ..
, – , – , .
– . . ..
– . . ..
1. – ()
˸ ( – , ) , , , , ( 30 ) / ( 24 ). ( 1-2 ), 5-20% , , , . , , , , , , , , , , , , . , , , (Mott TF et al., 2012). () (Teasdale G.M. Jennett B., 1974), 13-15 30 (Vos P.E. ., 2002, 2012). , , . , , .
: , , , , ; (1 ) , ( , , ), – . , , .
. . . ( 33-45 29-36 H) . – ( 1-1,5 ) – .
. , ( 18 28 ). , , , . , . , . . , 3 2 , . , , .
2.
2.1 ( )
1999 . (EFNS) һ (Task force on Mild Traumatic Brain Injury). 2002 EFNS , (13-15 ), /
30 , 60 , . , 3181 (CHIP) 100% (Smits M et al., 2007). 2012 , : , .
EFNS 2012 . 1 2. (Vos P.E. et al, 2012).
1. – .
| 13-15 | ||
| 1 | 15 | 1 |
| 2 | 15 | ≥ 1 ≥ 2 |
| 3 | 13-14 |
2. ( Canadian Closed Injury Rule – CHIP)
> 60 |
15 |
2 |
4 |
( ) |
40-60 |
2-4 |
1 |
2.2. ()
DSM-IV , ≥3 :
- 1)
- 2)
- 3)
- 4)
- 5)
- 6) ,
- 7)
- 8)
– (American Psychiatric Association. Task Force on DSM-IV, 2000).
-10 :
- 1)
- 2)
- 3)
- 4)
- 5)
- 6)
- 7)
- 8) , (World Health Organization (WHO), 2009).
3.
10% , 1-2% (Ibanez J., 2004; P. E. Vosa, 2012). 23199 , , , 8,2% , (Chen Y.H., 2011). , 10.21 (95% CI, 8.71-11.96), 4.61 (95% CI, 4.16-5.11) 2.32 (95% CI, 2.17-2.47) 3- , 1- 5- .
, , , (McKee A.C., 2013). , , 3 (Chen H., 2007), 3,8-4,3 (Bower J.H., 2003; Goldman S.M., 2006), – 1,8 (Morr JA, 1991).
, , . (second impact syndrome), (Wetjen N, 2010). , (brain vulnerability) , , , . (Giza CC, 2001).
4.
, .. . . , , ..
4.1. (, III)
Advanced Trauma Life Support (ATLS) Advanced Pediatric Life Support (APLS) [14] , ( ). , , , .
. , / , , ( , ), , [15-17]. , ( ). : <15 30 ; =15 – 30 2 , 4 2 . – ( ).
, (Culotta V.P. et al., 1996; Gomez P.A. et al., 1996) ( ).
, .. (Teasdale G.M. et al., 1990; Stein S.C. and Spettell C., 1995; Gomez P.A. et al., 1996) ( ).
( ) . , (van der Naalt J. et al., 1999). 24 ( ) 100% ( II) (van der Naalt J. et al., 1999). , , .
()
, . , , , .
, ( , eye-tracking technology) (Maruta J, 2010).
4.2.
, , . , (Stein SC, 1992) , 209 1538 (13,6%) , 58 (3,8%) . ( ) (Haydel M.J. et al., 2000; Stiell I.G. et al., 2001).
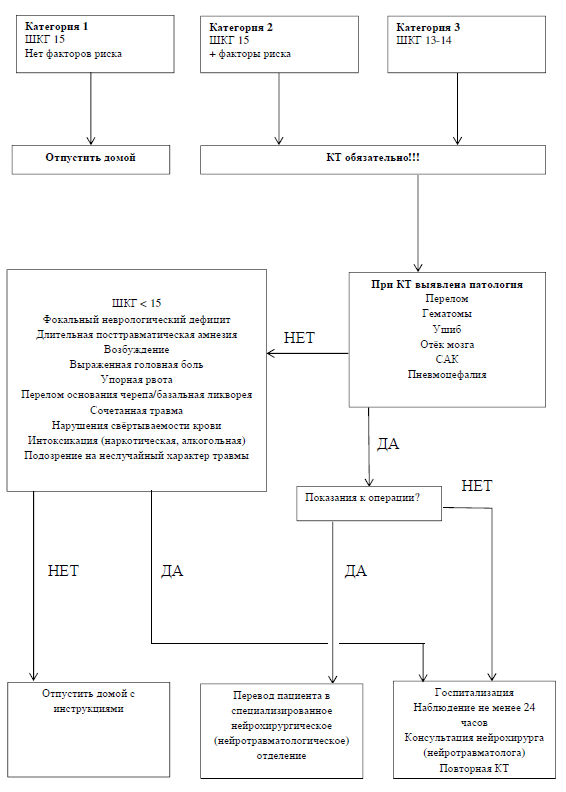
EFNS , (. 1).
:
- 1 (. 1). (. 1) ( ).
- 5 (Chalice study [7] North American [13] prospective cohort study) ( ).
- 5 , , ( ).
- 2 : , ( ), ( 5 ), , ( ).
- 2 , , , , ( ).
- – ( ).

.1. – . ;
4.3. ()
, , , , – , -, -, , . , (Henry L.C., 2014; Shin S.S., 2014).
– (Wilson J.T. et al., 1988; Yokota H. et al., 1991; Levin H.S. et al., 1992; van der Naalt J. et al., 1999). , . – , , (Zakharova N et al., 2014).
4.4. – ()
(, , .). ( , , ), . , . 3-5 .
4.5. ()
. ( .., 2014) , . ( 13-15 ) . , .
-10:
- S06.0
- S06.3 ( ).
- F07.2
, , , (Genarelli T.A., 1971, 1973). (Povlishock J.T., 1996). , , , ( ), ( ) (Denny-Brown D. et al, 1941; Povlishock J.T., 1996). , , , , . , ( .., 1998; .., .., 1998). , , . , ; , . , (Denny-Brown D. et al, 1941; Povlishock J.T., 1996).
5.
45 (Jennett, 1996; Kraus et al., 1996). ˸ – () – 60-95% ( .. ., 2008; .. ., 1998). 22:1. 4:1. (0,04-0,29%) (Klauber et al., 1989). – , , , .
: , , ..
6.
() , .
, . . -, – .
, , , . . , , , . . , .
, , , , , , . , , .
. , , , , , , .
, . , . , – , , , , .
. – . ( ), , , . , , , , , 2-3 .
() . , , ( ), , , . ( ) . 2-3 .
, . , , , . -, -, , . , ; 3 7 , , . , , .
, , , ( , ..), , .
, , , . , .
. , , . -, -, . , . . , . , . ( , , , ); 2-3 .
7.
1.
- , , ( , , , , ) . ( )
- , <15 , , . ( )
- – 2 ( ).
:
, – . ( .., .., .., 2009). , .
, , , .
2.
, . , , , (Finnoff JT, 2011). , , , , , .
, , , . , , ( ), ( ), , , , . (Schierhout G. and Roberts I., 1998).
(Saab M. et al., 1996).
()
0,2 3,1%. , , . (Stein S.C. and Ross S.E., 1992; Culotta V.P. et al., 1996; Gomez et al., 1996; Haydel M.J. et al., 2000; Stiell I.G. et al., 2001). (Paterniti S. et al., 1994; Servadei F. et al., 1995; Servadei, F. 1997). (Mendelow A.D. et al., 1979; Seelig J.M. et al., 1984; Servadei F., 1997).
()
4-5 , . ( 7 ) . 7-14 , 3-4 .
: . – 10-15% ( , ).
3. (EFNS)
| * |
|---|
– / . |
5 – , . |
5 . |
5 , . |
2 , ( ), ( 5 ), , . |
2 , , , , . |
, – , ( , , , , ) . |
, <15 , , . |
– . |
, , . : <15 30 ; =15 – 30 2 , 4 2 . -. |
– 2 . |
* :
- I: , , , – .
- II: , , .
- III: , , , .
:
- : , I II, .
- : , II.
- : , III.
.
:
- .., .. – // – . .: , 1998. .1. . 47-123.
- .., .., .. : // . – 2008. – .2. – 1. – . 12 -21.
- .. ?/ .., .., .. // . – 2009. – 9.- .64-68. – . 2009
- .. – // – . .: , 1998. .1. . 169-225.
- Culotta VP, Sementilli ME, Gerold K, Watts CC (1996). Clinicopathological heterogeneity in the classification of mild injury. Neurosurgery 38:245250.
- Denny-Brown D., Russel W.R. Experimental cerebral concussion // Brain. 1941. N 64. P. 93-164.
- Dunning J, Daly JP, Lomas JP, Lecky F, Batchelor J, Kway Jones K. Derivation of the children Ôs injury algorithm for the prediction of important clinical events decision rule for injury in children. Arch Dis Child 2006; 91: 885891.
- Genarelli T.A. Cerebral concussion and diffuse brain injuries // In: Copper P. Injury. Baltimore, 1993. P.137-158.
- Genarelli T.A., Ommaya A.K., Thibault L.E. Comparison of linear and rotational acceleration in experimental cerebral concussion. In 15th Stapp Car Crash Conference Proceedings. New York: SAE, 1971 . P. 797-803.
- Gomez PA, Lobato RD, Ortega JM, De La Cruz J (1996). Mild injury: differences in prognosis among patients with a Glasgow Coma Scale score of 1315 and analysis of factors associated with abnormal CTfindings. Br J Neurosurg 10:453460.
- Haydel M.J., Preston C.A., Mills T.J. et al. (2000). Indications for computed tomography in patients with minor injury [see s]. N Engl J Med 343:100105.
- Krauss JK, Tränkle R, Kopp KH. Post-traumatic movement disorders in survivors of severe injury. Neurology. 1996 Dec;47(6):1488-92.
- Kuppermann N, Holmes JF, Dayan PS, et al. Identification of children at very low risk of clinically important brain injuries after trauma: a prospective cohort study. Lancet 2009; 374: 11601170.
- Levin H.S., Williams D.H., Eisenberg H.M., HighW.M.Jr, Guinto F.C. Jr (1992a). Serial MRI and neurobehavioural findings after mild to moderate closed injury. J Neurol Neurosurg Psychiatry 55:255262.
- Luke C. Henry. Understanding Concussive Injuries Using Investigational Imaging Methods. // Niranjan A., Lunsford L.D.: Concussion. Prog. Surg. Basel, Karger, 2014, vol 28, pp 63-74.
- Mendelow A.D., Karmi M.Z., Paul K.S., Fuller G.A., Gillingham F.J. (1979). dural haematoma: effect of delayed treatment. Br Med J 1:12401242.
- Mott TF1, McConnon ML, Rieger BP. Subacute to chronic mild traumatic brain injury. Am Fam Physician. 2012 Dec 1;86(11):1045-51.
- Paterniti S., Fiore P., Macri E. et al. (1994). dural haematoma. Report of 37 consecutive cases with survival. Acta Neurochir (Wien) 131:207210.
- Povlishock J.T. An Overview of barin injury models. / In Raj K. Narayan, James E. Wilberger, jr., John T. Povlishock Neurotrauma. USA, 1996 Chapter 97. P. 1325- 1336.
- Saab M., Gray A., Hodgkinson D., Irfan M. (1996). Warfarin and the apparent minor injury. J Accid Emerg Med 13:208209.
- Samuel S. Shin et al. Detection of White Matter Injury in Concussion Using High- Definition Fiber Tractography. // Niranjan A., Lunsford L.D.: Concussion. Prog. Surg. Basel, Karger, 2014, vol 28, pp 86-93.
- Schierhout G., Roberts I. (1998). Prophylactic antiepileptic agents after injury: a systematic review. J Neurol Neurosurg Psychiatry 64:108112.
- Seelig J.M., Marshall L.F., Toutant S.M. et al. (1984). Traumatic acute epidural hematoma: unrecognized high lethality in comatose patients. Neurosurgery 15:617620.
- Servadei F. (1997). Prognostic factors in severely injured adult patients with epidural haematomas. Acta Neurochir (Wien) 139:273278.
- Servadei F., Vergoni G., Staffa G. et al. (1995). dural haematomas: how many deaths can be avoided? Protocol for early detection of haematoma in minor injuries. Acta Neurochir (Wien) 133:5055.
- Smits M, Dippel DW, de Haan GG, et al. Minor injury: guidelines for the use of CT. A multicenter vali- dation study. Radiology 2007; 245: 831838.
- Stein S.C., Ross S.E. (1992). Mild injury: a plea for routine early CTscanning. J Trauma 33:1113.
- Stein SC, Spettell C (1995). The Injury Severity Scale (HISS): a practical classification of closed- injury. Brain Inj 9:437444.
- Stiell I.G., Wells G.A., Vandemheen K. et al. (2001). The Canadian CT Rule for patients with minor injury. Lancet 357:13911396.
- Teasdale G.M., Jennett B. (1974). Assessment of coma andimpaired consciousness. A practical scale. Lancet 2:8184.
- Teasdale GM, Murray G, Anderson E et al. (1990). Risks of acute traumatic intracranial haematoma in children and adults: implications for managing injuries. Br Med J 300:363367.
- van der Naalt J, van Zomeren AH, Sluiter WJ, Minderhoud JM (1999a). One year outcome in mild to moderate injury: the predictive value of acute injury characteristics to complaints and return to work [In Process Citation]. J Neurol Neurosurg Psychiatry 66:207213.
- Vos P.E. et al (2012). Mild traumatic brain injury. European Journal of Neurology 2012, 19: 191198.
- Vos P.E. et al. (2002). EFNS guideline on mild traumatic brain injury: report of an EFNS task force. European Journal of Neurology 2002, 9: 207219.
- Wilson J.T., Wiedmann K.D., Hadley D.M. et al. (1988). Early and late magnetic resonance imaging and neuropsychological outcome after injury. J Neurol Neurosurg Psychiatry 51:391396.
- Yokota H., Kurokawa A., Otsuka T., Kobayashi S., Nakazawa S. (1991). ificance of magnetic resonance imaging in acute injury. J Trauma 31:351357.
- Zakharova N., Kornienko V., Potapov A., Pronin I. Neuroimaging of Traumatic Brain Injury, Springer International Publishing Switzerland 2014.
Источник
